Современные методы визуализации и их роль в планировании контактной лучевой терапии (брахитерапии)
Нуднов Н.В., Титова В.А.
В онкологии в условиях вирусной пандемии особая и все возрастающая роль принадлежит проблеме эффективного использования локального метода терапевтического воздействия лучевой терапии (ЛТ) у пациентов с различными формами, органной и внеорганной распространенностью опухоли. Озабоченность и необходимость стратификации методов лечения онкологических заболеваний в условиях вирусно-бактериальной агрессии, определения терапевтических приоритетов констатируют не только онкологи, но и юристы для защиты гражданских интересов и прав пациентов [1]. При этом несколько десятилетий мы участвуем в эволюционном процессе внедрения и широкомасштабного использования современных методов диагностики и лечения злокачественных новообразований различной локализации. Достижения и перспективы ощутимы, так как результаты длительного стойкого 5- и 10-летнего излечения у отдельных категорий пациентов, например с социально значимыми опухолями (раком шейки матки и раком предстательной железы), превышают 95% уровень достоверности [2, 3]. Тем не менее в условиях новых социальных и медицинских реалий необходимо акцентировать внимание на некоторых позициях, которые становятся приоритетными в лечении онкологических больных с учетом утвержденных Минздравом России медицинских стандартов оказания высокотехнологичной медицинской помощи [4].
Безусловно, необходимо четко стратифицировать медицинские возможности, предоставляемые пациентам на территории России, чтобы не отвлекать необходимые финансовые средства от решения других важных задач медицины. Это касается комплексной диагностики опухолей в условиях прошедшей вирусно-бактериальной пандемии и возможности локального повторения инфицирования больших контингентов, что требует сегодня:
- активизации клинической работы врачей профильных и смежных специальностей для получения анамнестических данных о перенесенной бактериальной и вирусной инфекции, в том числе больничной (группа стафилококка, HPV и др.), с формированием выдаваемого на руки пациенту заключения для персонификации лечения - хирургического, химиотерапевтического или ЛТ;
- формирования прецизионного алгоритма ультразвукового исследования (УЗИ) онкологического больного, которое должно быть выполнено во всей полноте для получения данных о локализации первичной опухоли, ее линейных размерах, объеме, глубине инвазии и состоянии зон регионарного метастазирования - определенных групп лимфатических узлов с теми же объективными критериями (при более высоком уровне УЗИ важными для проведения ЛТ и химиотерапии являются данные о состоянии тканевого кровотока как одного из факторов инициальной радиохимиочувствительности);
- при рентгенологических диагностических исследованиях - контроля на уровне специалистов-диагностов состояния костного и тканевого анатомического субстрата анализируемой зоны с определением качественных характеристик опухоли от ее размеров до признаков пролиферативного или деструктивного роста, что впоследствии предоставит возможность индивидуализировать параметры реализуемой ЛТ (от объема облучения до режима фракционирования и суммарных терапевтических доз).
Особенности периода вирусной пандемии существенно расширили показания для компьютерной томографии (КТ) легких, что требует тщательного контроля результатов КТ, а также магнитно-резонансной томографии (МРТ) у пациентов с любыми онкологическими заболеваниями, поскольку данные исследования сопряжены со значительными финансовыми затратами как в рамках программы обязательного медицинского страхования (ОМС), так и при хозрасчетных формах реализации диагностического процесса. По результатам позитронно-эмиссионной томографии с КТ (ПЭТ-КТ) у пациентов с любыми заболеваниями следует регистрировать накопление радиофармпрепарата с повышенным или умеренно повышенным уровнем и размеры патологического очага в визуализируемых органах.
При подозрении на онкологическое заболевание целесообразно направление пациентов в профильные стационары для проведения адекватной биопсии, а междисциплинарный консилиум обеспечивает стандартизацию лечения и дальнейшую профильную маршрутизацию пациента, сохраняя принцип начала противоопухолевого лечения через 12 дней после морфологической верификации диагноза [4].
Результаты исследований последних лет констатируют, что современная конформная ЛТ является радикальным и высокоэффективным методом противоопухолевого лечения рака различной локализации. Результативность терапии существенно возрастает с применением контактной ЛТ - брахитерапии (БТ) [5-7]. При этом существенную роль в повышении эффективности противоопухолевого лечения играют современные методы визуализации - УЗИ, КТ, МРТ [7-9]. Высокая частота местнораспространенных форм рака и рецидивов заболевания, однако, требует расширения клинических показаний для применения комплексных программ противоопухолевого лечения. В этих условиях возрастает роль методов, обеспечивающих гарантию качества всех компонентов комплексной терапии, включая ЛТ, одним из которых сегодня рассматривается привлечение методов визуализации (УЗИ, КТ, МРТ и ПЭТ-КТ) к вопросам 3D-планирования ЛТ, в том числе БТ [10-13].
Диагностический алгоритм использования современных методов визуализации
Анализ публикаций Российского научного центра рентгенорадиологии (ФГБУ «РНЦРР») по использованию методов визуализации для планирования БТ у 1814 больных раком различной локализации показал преобладание УЗИ- (100%), КТ- (80%) и реже МРТ-технологий у 50% пациентов в рамках стандартизованных вариантов ручного оконтуривания мишени с учетом определяемых радиотерапевтом трех контуров - высокого, среднего и низкого риска. Данные ПЭТ-технологий были использованы после диагностических рекомендаций других учреждений в 20% случаев.
Алгоритм применения современных методов визуализации (УЗИ, КТ, МРТ) в рамках диагностического и топометрического исследований, принятый в ФГБУ «РНЦРР», представлен на рисунке 1.

- Рис. 1. Алгоритм применения методов визуализации в первичной диагностике и планировании лечения, принятый в ФГБУ «РНЦРР»
- Fig. 1. Algorithm of application of visualization methods in primary diagnosis and treatment planning, adopted by the FSBI "RNCRR"
В рамках рассматриваемого алгоритма первый раздел относился к первичной и уточняющей диагностике онкологического заболевания. При этом для планирования ЛТ определялись линейные размеры визуализируемых опухолей, подлежащих конформной дистанционной ЛТ и БТ. Например, для рака шейки и тела матки определяли их размеры и объем (рис. 2, а), а также размеры М-эхо с толщиной неизмененной стенки матки (рис. 2, b). Данные эластографии и характеристики кровотока (рис. 3) использовали для выбора условий БТ (вид эндостата, его геометрия) и косвенной оценки радиохимиочувствительности. Именно таким образом диагностические данные были применены для определения размеров, объема опухоли-мишени и ее оконтуривания при планировании БТ.
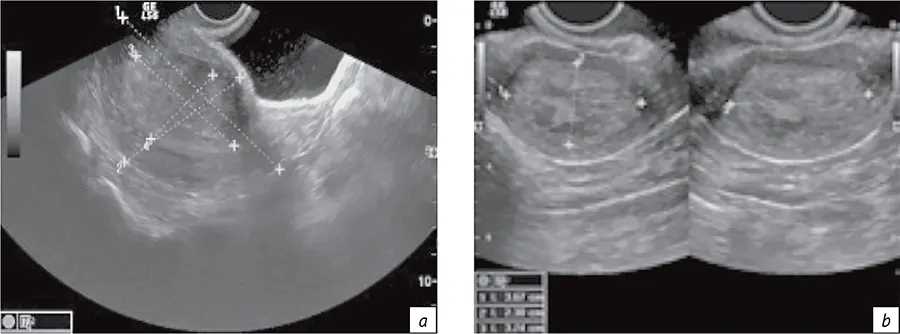
- Рис. 2. Визуализация и размеры органа по данным УЗИ при раке шейки матки (a) и раке тела матки (b)
- Fig. 2. Visualization and dimensions of the organ according to ultrasound data for cancer of cervix uteri (a) and corpus uteri (b)
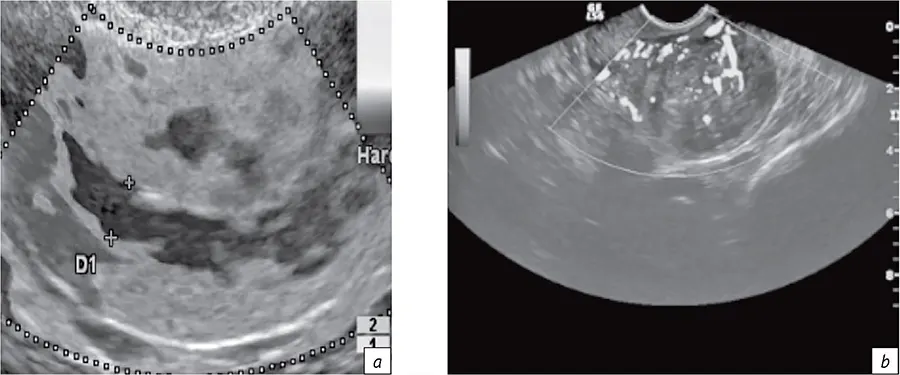
- Рис. 3. Визуализация зон интереса и оценка кровотока органа по данным эластографии (a), интенсивности кровотока по данным УЗИ (b) при раке тела матки
- Fig. 3. Visualization of areas of interest and assessment of organ blood flow according to elastography data (a) and blood flow intensity according to ultrasound data (b) for cancer of the corpus uteri
Диагностическая информация, получаемая при МРТ и в последние годы при ПЭТ-КТ существенно расширяет возможности индивидуального планирования ЛТ, но эти методы визуализации имеют определенные финансовые и методические ограничения в профильных лечебных учреждениях (рис. 4), так как требуют выделения самостоятельного времени, оснащения (наличия МРТ-совместимых эндостатов) и медицинских условий проведения МРТ-исследования при введенных эндостатах/ интрастатах.
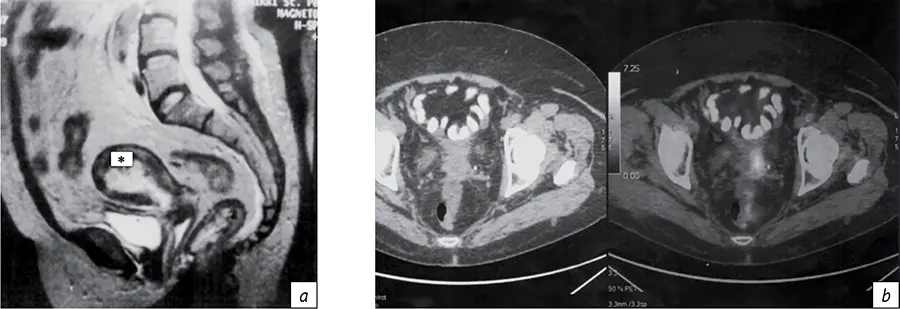
- Рис. 4. Визуализация полости матки (*), контрастированного мочевого пузыря и толстой кишки по данным МРТ (а); рецидива рака шейки матки по данным ПЭТ-КТ (b)
- Fig. 4. Visualization of the uterine cavity (*), contrast-enhanced bladder and colon according to MRI data (a); recurrent cervical cancer according to PET-CT data (b)
Второй раздел предусматривал проведение самостоятельного топометрического исследования с введенными эндостатами и контрастированием органов риска. Было выявлено, что визуальная картина, полученная на этом этапе с помощью УЗИ, оказывается менее информативной в силу субъективного восприятия сигнала по сравнению с КТ, которая реально отображает не только внешние контуры опухоли и органы риска, но и костные структуры, комбинированные (металл и пластик) эндостатические устройства и детекторы для прямой дозиметрии (стинтилляционные или термолюминесцентные) (рис. 5).
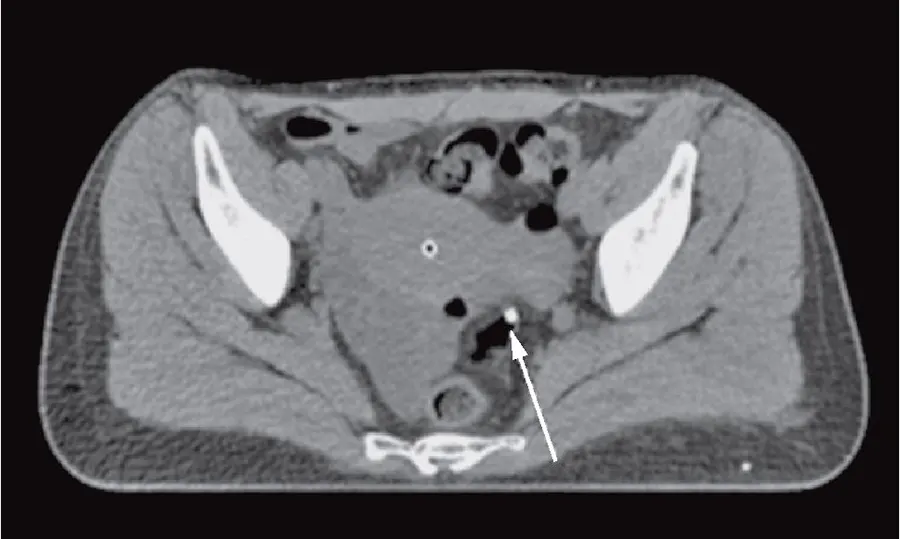
- Рис. 5. КТ матки с введенными метракольпостатом, детектором сцинтилляционного дозиметра (стрелкой указана прямая кишка)
- Fig. 5. Uterine CT with injected metracolpostat, a scintillation detector (the arrow indicates the rectum)
Опыт ФГБУ «РНЦРР» позволяет констатировать, что КТ-технология крайне востребована для визуализации эндостатов, детекторов дозиметров для прямого контроля доставляемых доз и собственно планирования БТ при всех видах опухолевого процесса (рис. 6), а контактная высокомощностная БТ сохраняет свою решающую роль в достижении стойкого излечения опухолей в рамках как комбинированного, так и самостоятельного радиотерапевтического воздействия [1-3, 9]. При этом КТ-топометрия проводится в режиме повторного исследования при высокой степени (более 50%) резорбции опухоли для коррекции не только вида и способа размещения эндостатов для БТ, но и собственно самого плана лечения по клиническим показаниям.
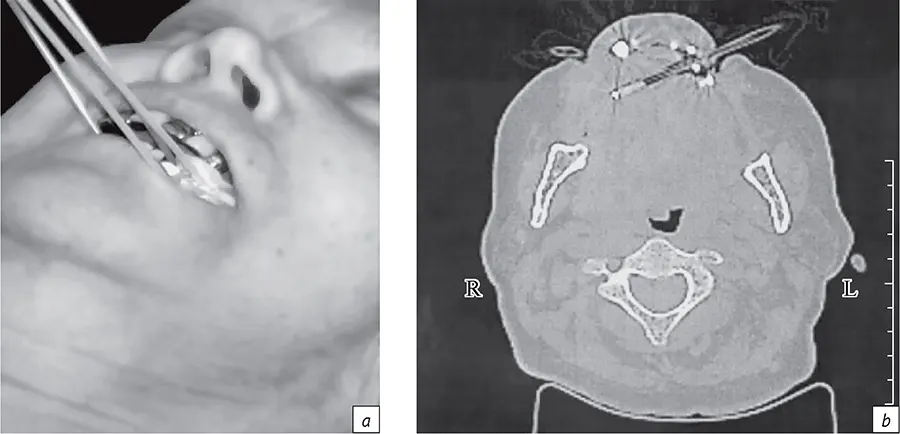
- Рис. 6. Визуализация введенных в полость рта аппликаторов для БТ рака языка (а) и сцинтилляционного детектора для прямой дозиметрии в полости рта по данным КТ (b)
- Fig. 6. Visualization of applicators inserted into the oral cavity for BT for tongue cancer (a) and a scintillation detector for direct dosimetry in the oral cavity according to CT data (b)
В рамках третьего этапа реализации диагностического алгоритма осуществляется контроль эффективности лечения и мониторирование результатов ЛТ или комплексной терапии, а также дифференциальная диагностика лучевых осложнений и рецидивов заболевания. Современная диагностическая стратегия предусматривает эволюционное движение от УЗИ к ПЭТ-КТ-технологиям для достоверного контроля за состоянием первичного очага, выявления рецидива или генерализации онкологического процесса, тем более что система ОМС гарантирует возможность получения высокотехнологичной диагностической помощи всем пациентам при наличии соответствующих клинических показаний.
Привлечение системной и локальной полихимиотерапии, в частности с использованием тар-гетных препаратов при ЛТ местнораспространенного и радиорезистентного рака и рецидивов заболевания, является необходимым атрибутом комплексного лечения, но при этом и существенно экономически обременительным для практического здравоохранения. Поэтому стандартизация технологий БТ гарантирует экономически эффективное распределение финансов, в том числе и для обеспечения системной терапии в необходимом объеме.
Брахитерапия в ФГБУ «РНЦРР» представлена преимущественно автоматизированными ее вариантами с дистанционным подведением малогабаритных закрытых источников высокой активности на основе радионуклидов 192Ir или 60Co в предварительно размещенных и фиксированных непосредственно в опухоли или ее ложе интрастатах или эндостатах (аппликаторах, позволяющих разместить источники без инвазивного радиохирургического вмешательства). Планирование проводится с использованием систем 3D-дозиметрического и радиобиологического планирования, что, вместе с тем, требует и прямого контроля предписанной и реально подведенной доз излучения путем дозиметрии in vivo. Это является необходимым фактором обеспечения гарантии качества БТ и профилактики осложнений, которые часто сопровождают комбинированное и комплексное лечение онкологических пациентов [2, 9]. В отличие от дистанционного облучения, при БТ преобладает физический закон снижения мощности дозы по квадрату расстояния, что учитывается при построении терапевтического изодозного распределения от одного или группы излучателей, часто ориентированных в нескольких плоскостях. Поэтому необходимо обеспечить совпадение созданного многоплоскостного изображения эндостатов, предписанного и реально выполненного во время реализации дозиметрического плана облучения.
Ошибки в определении объема облучения и органов риска (D 2 см3) при реконструкции эндостатов и за счет смещения позиции источников достигают 4%, тогда как при несоответствии оконтуривания опухоли-мишени и органов риска - существенно больших значений (9% и 5-11% соответственно). Смещения интрастатов и аппликаторов от фракции к фракции определяют превышение дозы. В настоящее время дозиметрические неопределенности в D 2 см3 для органов риска за каждую фракцию между предписанной и полученной дозами составляют 20-30%, что может существенно влиять на рост частоты побочных эффектов. Расчетные разовые очаговые дозы (РОД) и гистограммы «доза-объем» сохраняют свое значение при необходимости их подтверждения в условиях повышения величины фракции результатами прямой дозиметрии сцинтилляционными или термолюминесцентными технологиями (рис. 7). Наш опыт позволяет признать целесообразность использования жестких конструкций эндостатов и оценки объема облучения для БТ со значением РОД по диагностическому контуру низкого риска.
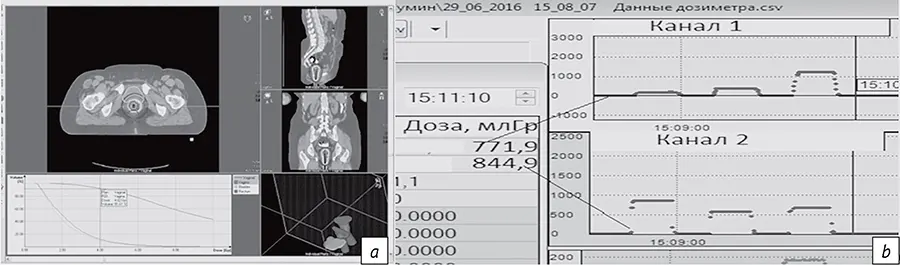
- Рис. 7. Визуализация дозного контура, соответствующего значению разовой очаговой дозы, представлена в поперечной, сагиттальной и фронтальной плоскостях, а также в виде гистограммы «доза-объем» для послеоперационного облучения рака тела матки (а). Результаты прямой дозиметрии сцинтилляционными детекторами в органах риска (b)
- Fig. 7. Visualization of the dose contour corresponding to the value of a single focal dose is presented in the transverse, sagittal, and frontal planes, as well as in the form of a dose-volume histogram for postoperative irradiation of cancer of corpus uteri (a). Results of direct dosimetry with scintillation detectors in the organs at risk (b)
Инновационные технологии
В ФГБУ «РНЦРР» совместно с АО «НИИТФА» в настоящее время проводятся исследования по созданию отечественного инновационного брахитерапевтического комплекса «Брахиум», медицинский раздел которого основан на длительном эволюционном опыте использования БТ при раке различной локализации [6, 14]. Новые позиции касаются медицинских рекомендаций Центра по использованию линейки закрытых источников, реализации положений по контролю за позиционированием малогабаритных источников, новых технических конструктивных решений, модернизации способов регистрации дозы и ее контроля во время сеанса облучения. Преимуществами комплекса являются двукратное снижение цены продукта и сервисного обслуживания на внутреннем рынке Российской Федерации, а также возможность сервисного обслуживания в короткие сроки с меньшей зависимостью от зарубежных комплектующих устройств. Это расширяет возможности экономии средств для более широкого включения современных методов визуального контроля - МРТ и ПЭТ-КТ для планирования конформных дистанционных ЛТ и БТ.
Современным подходом к планированию БТ является внедрение визуальных технологий на базе интегрированных компьютерных программ оконтуривания. В Центре проходит клиническая апробация системы двойного и тройного оконтуривания опухоли-мишени и органов риска по МРТ- и КТ-технологиям (Brainlab) согласно сформулированным радиотерапевтом и медицинским физиком требованиям к формированию терапевтического дозного распределения, которые обеспечивают достижение планируемой формы терапевтического изодозного распределения в трех плоскостях и объеме, позволяют оптимизировать формализацию задания по объему облучения или РОД и снижать по приоритетам дозовую нагрузку на органы риска [2]. Поэтому привлечение МРТ и ПЭТ-КТ к планированию конформной ЛТ и БТ считаем оправданным, несмотря на увеличение экономических затрат на ЛТ, показания к которой должны быть расширены в период вирусной пандемии.
Заключение
КТ-топометрия является основным методом визуализации в планировании высокомощностной БТ рака различной локализации, а изготовление слайсов для точного планирования БТ следует проводить с шагом 3 мм.
Ввиду наличия специального оборудования и технологии УЗИ сохраняет свое первостепенное значение для планирования БТ рака предстательной железы.
С целью наилучшего определения объема облучения для формирования предписанной дозы значение РОД должно быть персонализировано и корректироваться в динамике по клиническим показаниям по данным КТ и МРТ.
МРТ позволяет улучшить визуализацию мягких тканей и контроль объема опухоли органов риска, однако для детализации внешнего и внутреннего контуров эндостатов необходим индивидуальный подбор условий МРТ-исследования. МРТ-контроль БТ в режиме реального времени - важная для планирования БТ, но экономически затратная процедура, требующая логистического обоснования и специального оснащения брахитерапевтическо-го комплекса, а также клинического и финансового подтверждения.
При мультифокальном совмещении УЗИ-и МРТ-изображений титановых и пластиковых эндостатов существует определенный риск ошибок.
При КТ- и МРТ-визуализации целесообразно сравнение и констатация необходимости привлечения МРТ-исследования к планированию БТ.
Остаются дискуссионными вопросы о необходимости использования данных диагностической МРТ для коррекции плана облучения, полученного с помощью КТ, по клиническим показаниям, а также об условиях официального финансирования процедуры МРТ/ПЭТ-планирования БТ при реальном подтверждении факта доказательного улучшения результатов лечения.
Литература
- Чернусь Н.Ю., Кедрова А.Г., Красильников С.Э., Иванинский О.И. Особенности оказания онкологической помощи в условиях пандемии COVID-19: взгляд юриста и клинициста. Опухоли женской репродуктивной системы. 2020; 16(1): 85-90. https://doi.org/10.17650/1994-4098-2020-16-1-85-90.
- Солодкий В.А., Павлов А.Ю., Титова В.А., Цыбульский А.Д. Контактная лучевая терапия (брахитерапия): клиническая концепция прямой дозиметрии [in vivo] и гарантия качества лучевой терапии. Вопросы онкологии. 2020; 66(4): 3968-403. https://doi.org/10.37469/0507-3758-2020-66-4-398-403.
- Титова В.А., Паньшин Г.А., Шевченко Л.Н. и др. Послеоперационная конформная лучевая терапия рака шейки и тела матки: роль контактной лучевой терапии. Трудный пациент. 2019; 17(8-9): 33-6. https://doi.org/10.24411/2074-1995-2019-10060.
- Титова В.А. Рак орофарингеальной области - требуется ли смена приоритетов в условиях интенсивной системной бактериально-вирусного воздействия. Голова и шея. 2020; 8(3): 76-9. https://doi.org/10.25792/HN.2020.8.3.76-79.
- Каприн А.Д., Галкин В.Н., Иванов С.А. и др. Брахитерапия в лечении рака влагалища. Biomedical Photonics. 2016; 5(1): 22-6.
- Солодкий В.А., Титова В.А. Автоматизированная контактная лучевая терапия - условия эффективного использования в практическом здравоохранении. Вопросы онкологии. 2016; 62(5): 688-93.
- Солодкий В.А., Сергеев Н.И., Титова В.А. КТ и МРТ-визуализация эндостатов для контактной лучевой терапии на внутри-полостных аппаратах нового поколения. Медицинская физика. 2020; 3: 53-8.
- Титова В.А., Коконцев Д.А., Ивашин А.В., Хромов А.Б. Контактная лучевая терапия на аппарате АГАТ-ВТ с использованием отечественных систем визуализации и планирования. Вестник Российского научного центра рентгенорадиологии. 2016; 16(3): 9.
- Kreynina J, Burnashkina SP, Nudnov NV, Solodky VA. Capabilities of new complex pelvic MRI examination in vagina neoplastic lesion diagnosis and treatment planning. 15th Biennial Meeting of the International Gynecologic Cancer Society. Melbourne, Australia, November 8-11; 2014.
- Павлов А.Ю., Титова В.А., Цыбульский А.Д. и др. Высокомощностная брахитерапия рака предстательной железы: прямая дозиметрия in vivo - важный фактор повышения эффективности лечения и снижения частоты осложнений. Вопросы онкологии. 2019; 65(4): 596-602.
- Паньшин Г.А., Титова В.А., Петровский В.Ю. Рак полового члена: современные позиции органосохраняющего лучевого лечения. Трудный пациент. 2019; 17(11-12): 44-7. https://doi.org/10.24411/2074-1995-2019-10087.
- Титова В.А., Коконцев Д.А., Сумин А.В. и др. Дозиметрия in vivo при контактной лучевой терапии. Медицинская физика. 2019; 2: 24-30.
- Vasil’ev VN, Sumin AV, Medvedkov AM, et al. Calculation of the MKD-04 scintillation dosimeter for g radiation from a 192Ir sourse. Biomed Eng. 2020; 54(2): 113-6. https://doi.org/10.1007/s10527-020-09985-3.
- Солодкий В.А., Титова В.А, Белле Т.С. и др. Контактная лучевая терапия с использованием отечественного комплекса АГАТ-ВТ: руководство для врачей и медицинских физиков. М.: Аспект Пресс; 2018: 191 с.
