Реабилитация после COVID-19: резолюция Международного совета экспертов Евразийской ассоциации терапевтов и Российского кардиологического общества

Арутюнов А. Г., Сеферович П., Бакулин И. Г. и др.
К средине 2021 г. число переболевших новой коронавирусной инфекции (COVID-19) в мире, по официальным данным, приблизилось к 230 млн, но с учетом бессимптомных форм это число значительно больше. Изучение последствий перенесенной COVID-19, а также тактика действий в постковидном периоде представляет особый интерес и имеет множество спорных и нерешенных вопросов [1].
Согласно определению, понятие постковидного синдрома включает в себя признаки и симптомы, развившиеся во время или после перенесенного COVID-19 и продолжающиеся >12 нед., которые не могут быть объяснены другой причиной [2]. Значимость постковидного синдрома определяется существенным влиянием на качество жизни пациентов, что требует оптимизации имеющихся или создания новых алгоритмов и стандартов по лечению таких больных.
В реальной клинической практике возникают трудности при разработке стандартов оказания медицинской помощи больным, перенесшим COVID-19, в связи с относительно небольшим накопленным клиническим опытом к настоящему моменту. Одним из источников, восполняющих пробел знаний, могут стать регистры.
Евразийской Ассоциацией Терапевтов (ЕАТ) в 2020г был создан регистр АКТИВ (Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2), в разработке которого и сборе данных принимали участие специалисты из 36 медицинских центров Российской Федерации, Республики Армения, Республики Беларусь, Республики Казахстан, Республики Киргизия, Республики Молдова и Республики Узбекистан. Регистр содержит в себе информацию более чем о 7500 пациентах, перенесших COVID-19 и имеющих коморбидные состояния [3]. Обсуждение накопленных мировым сообществом знаний с целью выработки путей оптимизации оказываемой медицинской помощи становится актуальной задачей.
Под эгидой ЕАТ 18 мая 2021г состоялся международный совет экспертов с участием специалистов из Армении, Беларуси, Германии, Италии, Казахстана, Киргизии, Молдавии, Португалии, России, Сербии, Словении, Узбекистана, Хорватии, Японии, посвященный анализу проблем в постковидном периоде.
Данный совет экспертов явился событием, позволившим провести обмен опытом ведущих специалистов различного профиля, полученным при лечении и наблюдении больных амбулаторного и стационарного профиля не только на момент заболевания, но и в последующий период (через 3 и 6 мес.) после условной реконвалесценции.
Основные вопросы, по которым была сформирована согласованная позиция экспертов:
- Сроки вакцинации у пациентов, переболевших COVID-19;
- Длительность сохранения одышки и интерстициальных изменений в легких; показания к реабилитации;
- Факторы риска (ФР) формирования тромбозов на постгоспитальном этапе;
- Дебют ишемической болезни сердца (ИБС) и артериальной гипертензии (АГ) в постковидном периоде;
- Ведение больных с декомпенсацией хронической сердечной недостаточности (ХСН) и пациентов с ХСН, возникшей de novo;
- Терапия пациентов с дисгликемией (сахарным диабетом (СД) 2 типа (СД 2) и впервые выявленной гипергликемией, которая может быть связана с применением глюкокортикоидов, стресс-индуцированной или с прямым воздействием вируса SARS-CoV-2 на бета-клетки поджелудочной железы);
- Проблемы острого повреждения почек (ОПП) и хронической болезни почек (ХБП) в постковидном периоде, нефропротективная терапия;
- Вопросы назначения ингибиторов протонной помпы (ИПП) на постгоспитальном этапе;
- Последствия антибиотик-ассоциированных поражений пищеварительной системы и их лечение.
Целью совета экспертов являлась разработка подходов для выявления пробелов в поставленных вопросах путем созыва междисциплинарной группы ведущих специалистов, выполнивших обзор современной литературы, а также представивших собственные данные для формирования практических рекомендаций по ведению пациентов в постковидном периоде.
По итогам совета экспертов были сформулированы рекомендации по внедрению полученной информации для применения в практическом здравоохранении.
Длительность сохранения иммунитета к SARS-CoV-2
Представлены результаты скринингового исследования, проведенного на базе НИИ Скорой помощи им. Н. В. Склифосовского, которое включало 100 пациентов с диагнозом COVID-19, вызванной SARS-CoV-2. Диагноз COVID-19 был установлен на основании клинических проявлений, результатов полимеразноцепной реакции (ПЦР) мазков из но-со- и ротоглотки, данным компьютерной томографии легких. Определение уровня иммуноглобулинов к COVID-19 проводилось через 14 дней после полного выздоровления и повторялось каждые 2-3 мес. По истечении 8 мес. снижение титров антител составило 61,6%. Установлено, что среди всех наблюдаемых у 12 пациентов (12%) уровень антител достиг пороговых значений. При более детальном анализе оказалось, что у этих больных исходный уровень IgG составлял <50 Ед/мл. Подобная картина наблюдалась у 21 человека (21%), темп снижения антител равнялся 68,9%, в отличие от тех пациентов, чей уровень IgG был >50 Ед/мл и снижение титра антител составило 60,1%.
После разделения пациентов по полу, наблюдалась тенденция к более быстрому снижению уровня антител у женщин, чем у мужчин (на 64,3% и 53,8%, соответственно).
В другом исследовании “ОТКЛИК” (1200 пациентов, 6 мес. наблюдения), которое выполнено на базе ВМедА, существенным фактором, влияющим на концентрацию антител, является возраст: с увеличением возраста от 18 до 69 лет его концентрация в крови увеличивается вдвое. Титр IgG к SARS-CoV-2 на 45 сут. после заболевания определяется у всех переболевших, что свидетельствует об обязательном формировании гуморального иммунитета у пациентов, перенёсших COVID-19 любой степени тяжести. Титр антител постепенно нарастает до наибольшего значения через 45 сут. с сохранением этого уровня к 60 сут. с последующей тенденцией к снижению к 90 и еще более — к 180 сут. от начала заболевания. Наибольшее стимулирующее влияние на титр антител оказывает тяжесть перенесенного COVID-19, в меньшей степени — для мужчин до 50 лет, и имеет максимальную выраженность для женщин старше 50 лет. Гендерные особенности заключаются еще и в том, что после 50 лет у мужчин уровень антител снижается вплоть до 180 сут., тогда как у женщин отмечается тенденция к их увеличению, особенно выраженная для женщин старшей возрастной группы.
Выводы
- За 8 мес. уровень антител снижался более, чем в 2 раза;
- У пациентов с титром IgG <50 Ед/мл через 8 мес. после перенесенного COVID-19 уровень антител в крови в 57% случаев достигал пороговых значений или антитела отсутствовали;
- Наблюдалась тенденция к более быстрому снижению титра IgG среди лиц женского пола.
Заключение совета экспертов:
- Первое определение уровня антител целесообразно проводить во временном диапазоне 30-45 дней после первого отрицательного ПЦР к SARS-CoV-2. В случае значений, не превышающих 3 нормы, повторять исследование каждые 3 мес.;
- При отсутствии или низком (пороговом) уровне антител в ранние сроки после выздоровления (<6 мес.) обосновано проведение вакцинации;
- Через 6 мес. после перенесенной COVID-19 для создания более мощного гибридного иммунитета (постинфекционного + поствакцинального) против SARS-CoV-2 необходимо рекомендовать вакцинацию всем пациентам.
Одышка у пациентов, госпитализированных с COVID-19
Одышка является одним из самых распространенных симптомов в постковидном периоде и ее распространенность может достигать 79% [4].
По данным пульмонологического центра (г. Нижний Новгород, анализ данных 83 пациентов), при госпитализации в стационар 6% имели одышку при значительной физической нагрузке, 25,5% — при обычной физической нагрузке, 15,5% — при незначительной физической нагрузке, 6% — в покое, 46% больных одышка не беспокоила.
Большая часть исследуемых (87%) соответствовали средней степени тяжести заболевания, а 12% пациентов имели тяжелое и крайне тяжелое течение заболевания.
По данным опроса 83-х пациентов, через 3 мес. после реконвалесценции COVID-19: 53% больных не имели одышки, 22% больных имели одышку при значительной физической нагрузке, 9% больных — при обычной физической нагрузке, 7% больных — при незначительной физической нагрузке, 9% больных — в покое.
При оценке одышки через 6 мес. после COVID-19: 51% больных не имели одышки, 5% пациентов имели одышку при значительной физической нагрузке, 14% пациентов — при обычной физической нагрузке, 12% пациентов — при незначительной физической нагрузке, 9% пациентов — в покое (рис. 1).
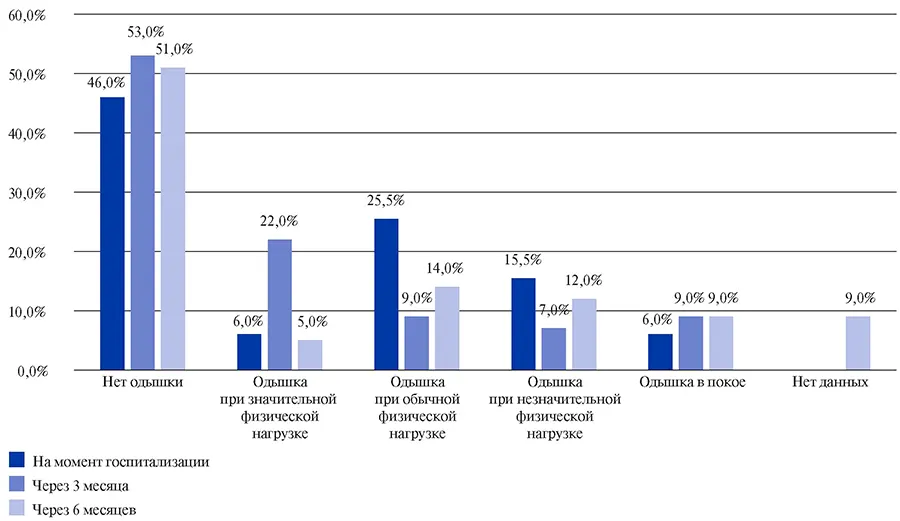
Рис. 1. Характеристика симптома одышки у пациентов, перенесших COVID-19, через 3 и 6 месяцев после выписки из стационара.
Примечание: N=83 пациента, находившихся на стационарном лечении. Женщины — 64% (53 человека); возраст 56±11,7 лет. Мужчины — 36% (30 пациентов); возраст 54,6±12,0 лет.
Сохранение одышки через 6 мес. чаще наблюдалось у больных с наличием сердечно-сосудистой патологии.
Согласно анализу данных 2024 пациентов, включенных в регистр АКТИВ, через 3 мес. 47,2% больных не имели одышки, 13% больных имели одышку при значительной физической нагрузке, 8% больных — при обычной физической нагрузке, 5,3% больных — при незначительной физической нагрузке, 1,3% больных — в покое.
Через 6 мес. одышка не беспокоила 26,3% больных, при значительной физической нагрузке одышка сохранялась у 4% больных, при обычной физической нагрузке у 3% больных, при незначительной физической нагрузке — у 1% пациентов, в покое — у 0,4% больных. Не удалось получить данные о 25,2% и 65,3% пациентов через 3 и 6 мес., соответственно (рис. 2).
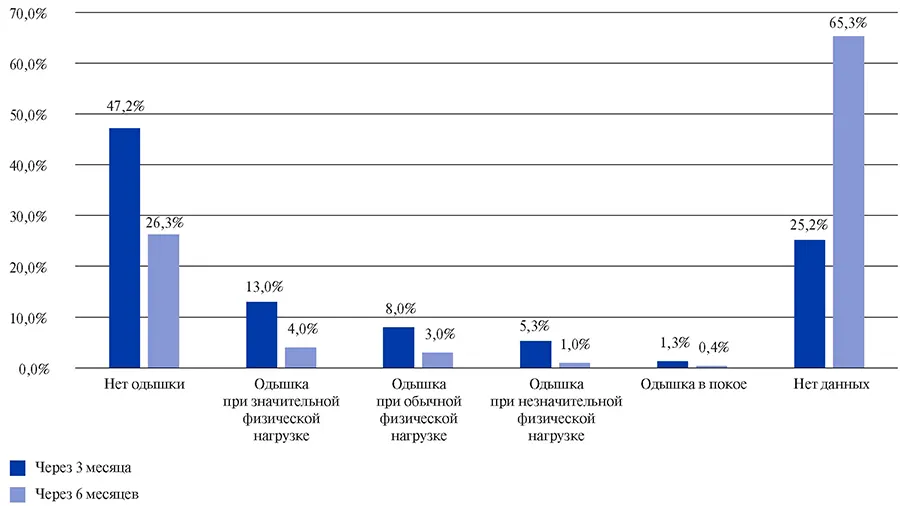
Рис. 2. Характеристика симптома одышки у пациентов, перенесших COVID-19, через 3 и 6 месяцев после выписки из стационара (данные регистра АКТИВ).
Заключение совета экспертов:
- При сохранении у пациентов одышки на протяжении 2-3 мес. после перенесенной COVID-19 рекомендовано проводить дообследование (диспансеризацию) у врача-терапевта, пульмонолога, кардиолога для уточнения причины;
- Объем индивидуальной реабилитации необходимо определять согласно актуальным методическим рекомендациям [5];
- Считать нецелесообразным пролонгирование, в т.ч. длительный прием (>2-4 нед.), пероральных глюкокортикостероидов (ГКС) на постгоспитальном этапе без четких показаний, определяемых врачом-пульмонологом;
- Не рекомендовать применение антифибротических препаратов, применяющихся для лечения прогрессирующих легочных фиброзов (нинтеданиб, пирфинедон и др.), ввиду недостаточного количества данных по их эффективности у пациентов с перенесенной COVID-19 в научной литературе.
Потенциальные тромботические риски после COVID-19
Из 2034 пациентов регистра АКТИВ были сформированы следующие группы:
Пациенты, имеющие ФР тромботических осложнений: избыточная масса тела (ожирение 1 степени и выше), возраст старше 50 лет;
Пациенты с повышением уровня Д-димера >1,5 норм на госпитальном этапе [6];
Пациенты с эпизодами тромбоза глубоких вен и/или тромбоэмболией легочной артерии (ТЭЛА) на госпитальном этапе.
У пациентов с ФР и/или тромботическими событиями на госпитальном этапе и в постковидном периоде уровень смертности, повторных госпитализаций, постановки новых диагнозов не превышал таковых значений у группы пациентов, перенесших COVID-19 без тромбозов.
Таким образом, основным выводом является отсутствие корреляции риска тромбозов на госпитальном этапе с аналогичным риском в постковидном периоде.
Статистический анализ базы данных регистра АКТИВ позволил выявить интересную статистически значимую закономерность: сочетания высокого уровня Д-димера с большей частотой жалоб на сердцебиение в постковидном периоде.
Всего из 2034 пациентов было зафиксировано 32 смерти, среди них 18 летальных исходов были связаны с сердечно-сосудистыми событиями. Так, по 1 пациенту погибли от ТЭЛА и острого коронарного синдрома, 2 пациента умерли в связи с острым нарушением мозгового кровообращения (ОНМК), 8 пациентов имели сердечно-сосудистый характер летального исхода без возможности уточнить причины. Среди умерших никто не получал ни антиагрегантную, ни антикоагулянтную терапии. Около 300 из 2034 человек получали антикоагулянты и/или антиагреганты после выписки.
Наблюдение за пациентами в постковидном периоде позволило выявить еще одну закономерность: пациенты с развившимися ИБС, ХСН, АГ, СД 2 de novo достоверно чаще повторно госпитализировались в стационар и имели более высокий риск тромбозов.
Заключение совета экспертов:
- Не считать уровень Д-димера на госпитальном этапе ключевым показателем для назначения антикоагулянтной терапии, т.к. он не является специфичным маркером тромботических рисков и может учитываться только при отрицательном результате в качестве исключения тромбоза;
- Рассматривать Д-димер как маркер воспаления и его возможную ассоциацию с неблагоприятным прогнозом смерти от COVID-19 только на госпитальном этапе [7, 8];
- Считать перенесенный COVID-19 самостоятельным ФР формирования тромбозов;
- Выделить в отдельную группу риска тромботических событий пациентов с дебютом новых заболеваний (ИБС, ХСН, АГ, СД 2) в постковидном периоде (до 6 мес. согласно имеющимся данным);
- Рекомендовать проведение дальнейших исследований применения шкалы CHA2DS2-VASc для назначения антикоагулянтов в постковидном периоде, ввиду недостаточного количества данных по этому вопросу.
Влияние различных форм ИБС на исход COVID-19 и сердечно-сосудистые события в постковидном периоде. Сердечная недостаточность и COVID-19: основные аспекты терапии
COVID-19 — это не респираторная инфекция, а системное воспалительное заболевание с существенным вовлечением сердечно-сосудистой системы. В настоящее время известно, что многие пациенты с COVID-19 (до 42%) уже имели ХСН до заражения SARS-CoV-2. Повреждение миокарда и сердечная недостаточность являются причиной смерти во время острого инфекционного периода у 7-33% больных [9]. В связи с этим Европейским обществом кардиологов были разработаны рекомендации по диагностике и лечению пациентов с сердечно-сосудистыми заболеваниями (ССЗ) в период пандемии. Что касается сердечной недостаточности, был подготовлен документ под названием “Обновленная клиническая практика по сердечной недостаточности 2019” (“Clinical practice update on heart failure 2019: pharmacotherapy, procedures, device sand patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology”). Последние изменения были внесены в 2021 г [10].
Проведен анализ данных регистра АКТИВ, в который включено >7500 пациентов. Средний возраст пациентов — 63,4 года, большинство пациентов женского пола — 54%. Среди госпитализированных пациентов встречаемость ИБС составила 23,1%, что более чем в 4 раза выше распространенности ИБС в России в целом. Полученные данные сопоставимы с таковыми в США и Китае (рис. 3) [11].
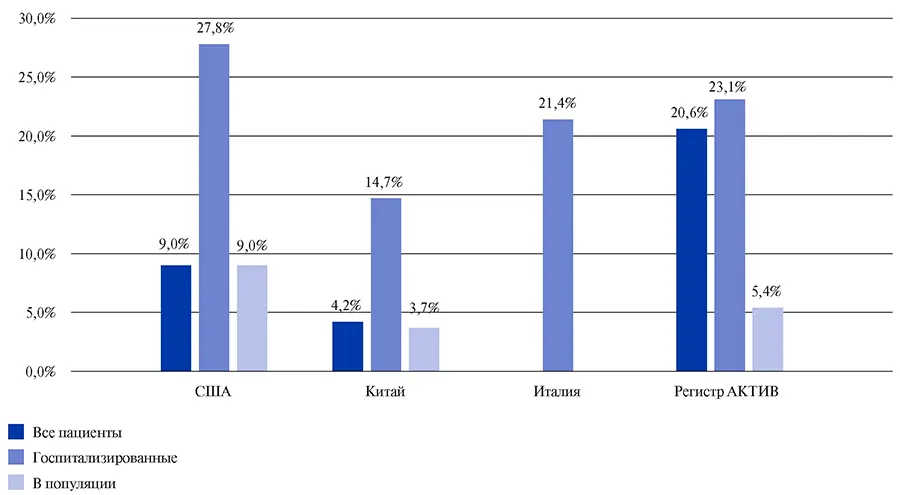
Рис. 3. Встречаемость ИБС при COVID-19 в различных регионах в зависимости от тяжести течения [12-14].
Среди умерших 50,5% пациентов имели в анамнезе ИБС. Факт наличия ИБС увеличивал риск летального исхода в 3,8 раз (отношение шансов 3,829, 95% доверительный интервал 3,032-4,836). В свою очередь, наличие инфаркта миокарда в анамнезе у пациентов с COVID-19 способствовало повышению риска летального исхода в 3 раза (отношение шансов 3,005, 95% доверительный интервал 2,165-4,170).
Характеристика умерших пациентов в зависимости от сопутствующих заболеваний представлена на рисунке 4 [15].
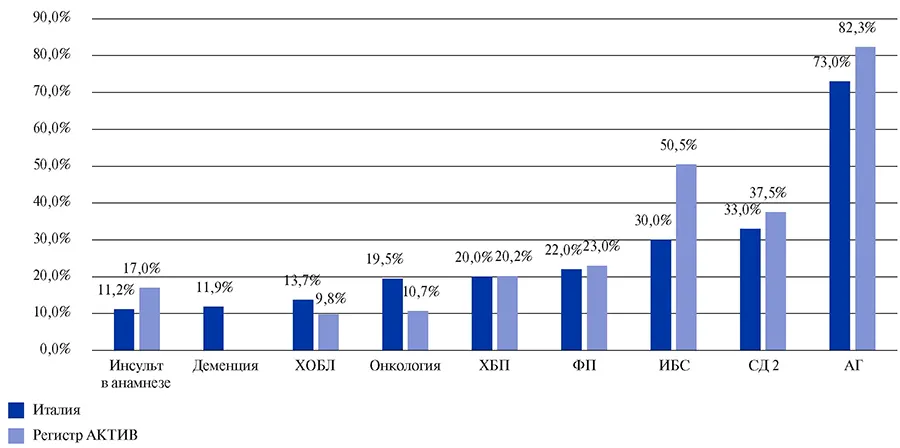
Рис. 4. Характеристика умерших пациентов в зависимости от сопутствующих заболеваний, сравнение 3200 смертельных исходов в Италии и данных регистра АКТИВ.
Сокращения: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, СД 2 — сахарный диабет 2 типа, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХОБЛ — хроническая обструктивная болезнь легких.
Согласно выборке Евразийского регистра АКТИВ, регулярный прием рекомендованных препаратов (ингибиторов ГМГ-КоА-редуктазы (статины), ингибиторов ангиотензинпревращающего фермента (иАПФ), блокаторов рецепторов ангиотензина-II (БРА), бета-адреноблокаторов (β-АБ), антиагрегантов (кроме ацетилсалициловой кислоты)) пациентами с ИБС до возникновения COVID-19 был ассоциирован со снижением риска летального исхода в ходе госпитализации.
Через 3 мес. после перенесенной COVID-19 в наблюдаемой популяции пациентов летальность составила 1,5%. Из 30 умерших больных в 15 случаях причина смерти не была установлена. Из 15 пациентов с известной причиной смерти летальный исход от сердечно-сосудистой патологии был зафиксирован у 12 человек (рис. 5).
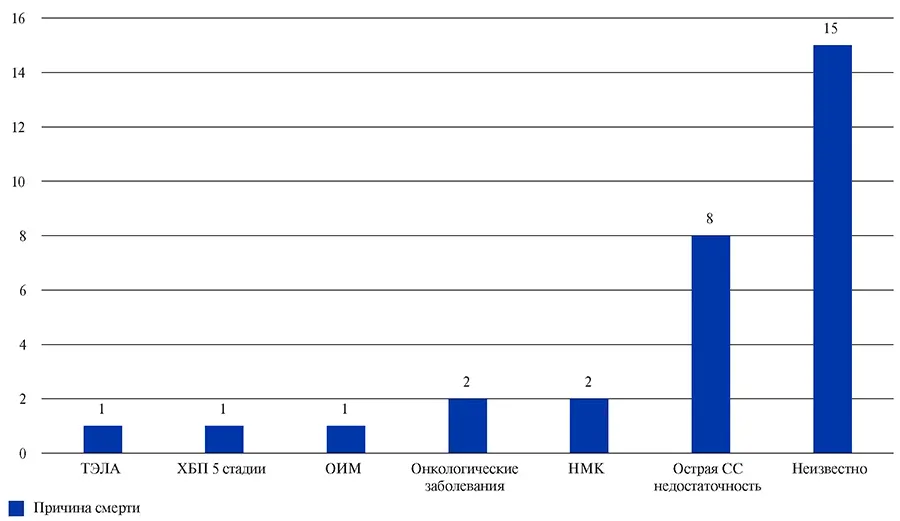
Рис. 5. Причины смертельных исходов через 3 мес. после выписки из стационара по данным регистра АКТИВ.
Сокращения: НМК — нарушение мозгового кровообращения, ОИМ — острый инфаркт миокарда, СС — сердечно-сосудистый, ТЭЛА — тромбоэмболия легочной артерии, ХБП — хроническая болезнь почек.
Через 3 мес. после перенесенной COVID-19 5,2% пациентов предъявляли жалобы на болевой синдром в области грудной клетки, 28% больных беспокоила одышка, 11,4% пациентов отмечали чувство сердцебиения, а у 20,1% пациентов развилась неконтролируемая АГ.
Через 6 мес. после перенесенной COVID-19 2,1% пациентов предъявляли жалобы на болевой синдром в области грудной клетки, 8,3% больных беспокоила одышка, 3,1% пациентов отмечали чувство сердцебиения, а у 9% пациентов развилась неконтролируемая АГ (рис. 6).
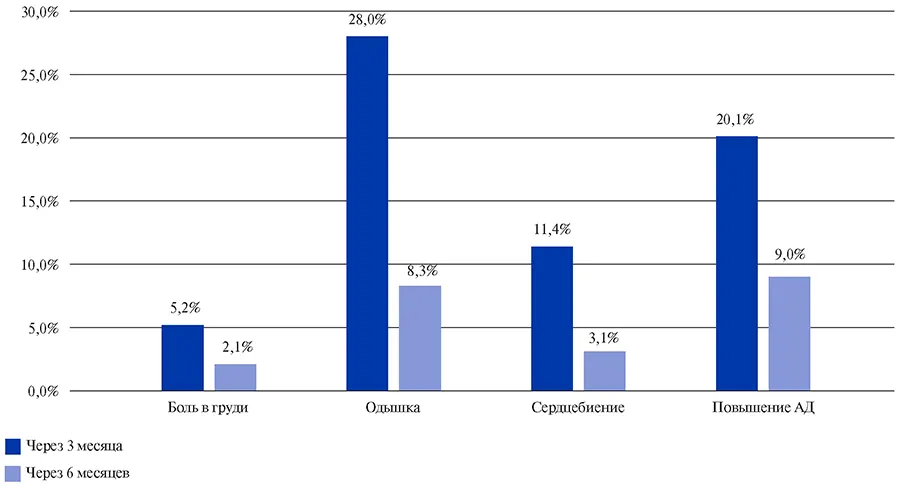
Рис. 6. Жалобы пациентов со стороны сердечно-сосудистой системы через 3 и 6 месяцев после COVID-19.
Сокращение: АД — артериальное давление.
Через 3 и 6 мес. после перенесенной COVID-19 у 5,9% пациентов были зарегистрированы вновь возникшие ССЗ: ИБС — в 1,3%, АГ — в 4,0%, ОНМК — в 0,2%, фибрилляция предсердий — в 0,4% случаев (рис. 7).
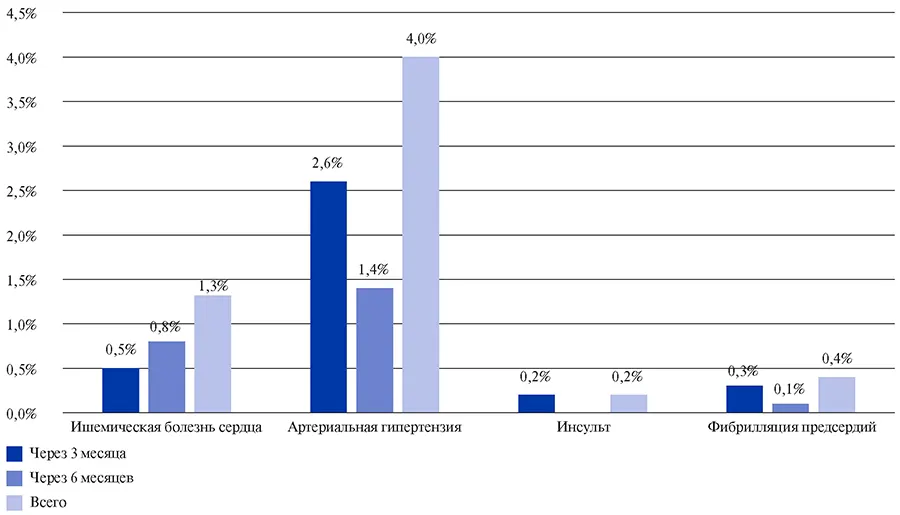
Рис. 7. Впервые диагностированные заболевания сердечно-сосудистой системы через 3 и 6 месяцев. после COVID-19.
Как известно, у пациентов с ИБС и повышенным уровнем высокочувствительного тропонина Т во время и после перенесенного COVID-19 летальность выше, чем при нормальных значениях данного показателя [16]. Это необходимо принимать во внимание, определяя риск неблагоприятного исхода и тактику ведения таких пациентов.
Выводы
- ИБС встречалась у 23% пациентов и являлась фактором высокого риска летального исхода у пациентов с COVID-19;
- По данным регистра АКТИВ, регулярный прием рекомендованных препаратов (статины, иАПФ, БРА, β-АБ, антиагреганты (кроме ацетилсалициловой кислоты)) пациентами с ИБС до возникновения COVID-19 ассоциировался со снижением риска летального исхода от COVID-19 [8];
- Среди известных причин смерти пациентов через 3 и 6 мес. после перенесенной COVID-19 преобладали сердечно-сосудистые;
- Через 6 мес. после перенесенной COVID-19 у 5,9% пациентов были зарегистрированы вновь возникшие ССЗ (ИБС, АГ, ОНМК и фибрилляция предсердий).
Заключение совета экспертов:
- Считать сохраняющийся повышенный уровень тропонина на постгоспитальном этапе прогностическим маркером тяжелого течения ИБС и ХСН;
- Пациенты с ИБС и перенесенным COVID-19 имеют повышенный риск нарушения липидного обмена и требуют дополнительного контроля уровня липопротеидов низкой плотности строго <1,4 ммоль/л, триглицеридов <1,7 ммоль/л. В качестве гиполипидемической терапии, предпочтение следует отдавать ингибиторам ГМГ-КоА-редуктазы (статины), при гипертриглицеридемии и второй линией следует назначать фибраты;
- При наличии жалоб на перебои в работе сердца и выявляемую тахикардию рекомендовать назначение традиционных лекарственных средств для контроля сердечного ритма: β-АБ или недигидропири-диновые антагонисты кальция и/или ингибиторов If-каналов [17, 18] (табл. 1);
- Для терапии вновь выявленной АГ рекомендовать придерживаться тактики с применением антигипертензивных препаратов, согласно клиническим рекомендация по ведению данной группы пациентов [19] (табл. 2);
- При возникновении ХСН de novo, а также ее декомпенсации у пациентов с анамнезом ХСН, рекомендовать приоритетное использование комплексной квадротерапии (БРА/ингибиторы неприлизина, β-АБ, антагонисты минералокортикоидных рецепторов, ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT-2 ингибиторы)) согласно консенсусу экспертов [21].
Таблица 1
Примеры препаратов и режим их дозирования для купирования тахикардии и жалоб на перебои в работе сердца у пациентов с COVID-19
Препарат | Начальная доза | Целевая доза |
Бета-адреноблокаторы | ||
Бисопролол | 1,25 мг 1 раз/сут. | 10 мг 1 раз/сут. |
Карведилол | 3,125 мг 2 раза/сут. | 200 мг 1 раз/сут. |
Метопролол, таблетки с пролонгированным высвобождением/пролонгированного действия | 12,5-25 мг 1 раз/сут. | 200 мг 1 раз/сут. |
Небиволол | 1,25 мг 1 раз/сут. | 10 мг 1 раз/сут. |
Блокаторы кальциевых каналов | ||
Верапамил | По 40 мг 3-4 раза/сут. | По 120-160 мг 3-4 раза/сут. |
Дилтиазем | По 60 мг 3 раза/сут. либо по 90 мг 2 раза/сут. | По 180 мг 2 раза/сут. |
Ингибиторы If-каналов | ||
Ивабрадин | 5 мг 2 раза/сут. | 5-75 мг 2 раза/сут. |
Таблица 2
Примеры групп препаратов для терапии АГ у пациентов с COVID-19 [20]
Рекомендации | Класс | Уровень |
Среди всех антигипертензивных препаратов, иАПФ, БРА, β-АБ, БКК и диуретики (тиазиды и тиазидоподобные, такие как хлорталидон и индапамид) продемонстрировали эффективное снижение АД и сердечно-сосудистых событий в РКИ и показаны в качестве основы антигипертензивной терапии. | I | А |
Комбинированное лечение рекомендуется для большинства пациентов с гипертонической болезнью как начальная терапия. Предпочтительные комбинации должны включать блокаторы РААС (иАПФ или БРА) с БКК или диуретиками, могут использоваться и другие комбинации пяти основных классов. | I | А |
β-АБ рекомендуется комбинировать с любым из основных классов АГП в особых клинических ситуациях: стенокардия, ПИКС, ХСН, контроль ЧСС. | I | А |
Рекомендуется начинать антигипертензивное лечение комбинацией двух препаратов, предпочтительно в одной таблетке (SPC). Исключение составляют пожилые “хрупкие” пациенты и пациенты с низким риском и гипертонией 1-го уровня (особенно если САД <150 мм рт.ст.). | I | В |
Сокращения: АГП — антигипертензивные препараты, АД — артериальное давление, БКК — блокаторы кальциевых каналов, БРА — блокаторы рецепторов ангиотензина-II, иАПФ — ингибиторы ангиотензинпревращающего фермента, ПИКС — постинфарктный кардиосклероз, РААС — ренин-ангиотензин-альдостероновая система, РКИ — рандомизированное контролируемое исследование, САД — систолическое артериальное давление, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений, β-АБ — бета-адреноблокаторы.
Влияние дисгликемии и ожирения на исход COVID-19 и выраженность постковидного синдрома. Важность гликемического контроля у пациентов с COVID-19 и СД — роль интенсивной инсулинотерапии
Согласно имеющимся международным данным, СД 2 характеризуется большим количеством неблагоприятных исходов на фоне COVID-19 [16, 22].
Для проведения всестороннего анализа влияния нарушений углеводного обмена на исходы COVID-19 все больные были разделены на следующие 4 группы: 1. СД 1 типа (СД 1), 2. СД 2, (обе группы имели анамнез по СД или гликированному гемоглобину >6,5%), 3. стрессорная гипергликемия, 4. ГКС-индуцированная гипергликемия. Две последние группы пациентов не имели диагностированного СД в анамнезе и/или гликированный гемоглобин составлял <6,5% и разделялись между собой фактом применения ГКС). Все пациенты были ранжированы по индексу массы тела (ИМТ).
Анализ данных регистра АКТИВ в отношении отдаленных последствий COVID-19 показывает, что одышка, агевзия, аносмия и отделение мокроты через 3 и 6 мес. после перенесенной COVID-19 встречались чаще у лиц с ожирением 2 степени и выше и СД 2, по сравнению с пациентами с СД 2 и ИМТ <35 кг/м2 (табл. 3).
Таблица 3
Жалобы и состояния в постковидном периоде у пациентов с СД 2 в зависимости от ИМТ
Жалобы и состояние | Через 3 мес. | Через 6 мес. | |||||
ИМТ <35 кг/м2 | ИМТ >35 кг/м2 | Р | ИМТ <35 кг/м2 | ИМТ >35 кг/м2 | Р | ||
Одышка | нет | 67/55% | 10/31% | <0,05 | 55/79% | 9/50% | <0,05 |
да | 56/45% | 22/69% | 15/21% | 9/50% | |||
Потеря обоняния и/или вкуса | нет | 154/99% | 35/90% | <0,01 | 83/100% | Ц19/91% | <0,01 |
да | 2/1% | 4/10% | 0/0% | 2/9% | |||
Отделение мокроты | нет | 154/99% | 36/93% | <0,05 | 82/99% | 19/91% | <0,05 |
да | 2/1% | 3/7% | 1/1% | 2/9% | |||
Першение/боли в горле | нет | 155/99% | 37/95% | ||||
да | 1/1% | 2/5% | |||||
Фибрилляция предсердий | нет | 156/100% | 38/97% | ||||
да | 0/0% | 1/3% | |||||
Ухудшение самочувствия | нет | 20/29% | 10/59% | ||||
да | 48/71% | 7/41% | |||||
Сокращение: ИМТ — индекс массы тела.
Анализ показал, что у пациентов с ожирением без СД не наблюдалось различий в частоте жалоб на постгоспитальном этапе по сравнению с группой больных с ожирением и наличием СД 2. Можно предположить, что именно ожирение, а не наличие СД 2 в постковидном периоде определяет риски пациента. Это косвенно подтверждается еще и тем, что у пациентов с СД 1, не имеющих ожирение, значимо реже встречалось ухудшение клинического статуса по сравнению с пациентами, имеющими СД 2, ГКС-индуцированную гипергликемию, а также стрессорную гипергликемию.
Из всех видов дисгликемии именно впервые возникшая гипергликемия (прежде всего стрессорная, в меньшей степени ГКС-индуцированная гипергликемия) наиболее часто была ассоциирована с неблагоприятным течением COVID-19.
В постковидный период пациенты с ГКС-индуцированной и стрессорной гипергликемией предъявляли большее количество жалоб, в т.ч. на чувство сердцебиения, общую слабость и плохое самочувствие. Среди таких пациентов было диагностировано большее количество вновь выявленных заболеваний. Так, пациенты со стрессорной гипергликемией статистически чаще по сравнению с СД 2 демонстрировали впервые выявленную АГ через 3 мес. после реконвалесценции COVID-19. Важно отметить, что в регистре АКТИВ в постковидный период впервые возникшие ГКС-индуцированная и стрессорная гипергликемии в 94% и 91% случаев, соответственно, трансформировались в СД 2 с управлением традиционными сахароснижающими препаратами.
Таким образом, у неадаптированных к нарушениям углеводного обмена пациентов с впервые возникшей гипергликемией (стрессорная гипергликемия или ГКС-индуцированная) COVID-19 имела более неблагоприятное течение и реализовалась в более выраженный постковидный синдром, чем у пациентов с СД 1 или СД 2.
Заключение совета экспертов:
- По данным регистра АКТИВ, ожирение обладает большей прогностической ценностью неблагоприятного течения COVID-19 в сравнении с наличием СД 2;
- Ожирение с ИМТ >35 кг/м2 является самостоятельным ФР более выраженного и длительного постковидного синдрома;
- Пациентов с дебютом гипергликемии (стрес-сорная и ГКС-индуцированная гипергликемия) выделить в отдельную группу риска неблагоприятного течения и исходов COVID-19, которые нуждаются в более строгом гликемическом контроле в периинфекционный период, чем пациенты с СД 2, адаптированные к хронической/эпизодической гипергликемии;
- Рекомендовано переходить на пероральную сахароснижающую терапию параллельно со снижением дозы вводимого инсулина короткого действия вплоть до его полной отмены. Предпочтение следует отдавать ингибиторам SGLT-2 (табл. 4).
Таблица 4
Примеры ингибиторов SGLT-2 и режим их дозирования для терапии дисгликемии у пациентов с COVID-19
Препарат | Терапевтическая доза |
Дапаглифлозин | 10 мг 1 раз/сут. |
Канаглифлозин | 100 или 300 мг 1 раз/сут. |
Эмпаглифлозин | 10 или 25 мг 1 раз/сут. |
ХБП и ОПП в рамках COVID-19
Анализ данных пациентов, включенных в регистр АКТИВ, позволил получить следующие результаты при оценке скорости клубочковой фильтрации (СКФ): 29,5% пациентов имели нормальную СКФ (>90 мл/ мин); 49,6% пациентов имели вторую стадию ХБП (СКФ 60-89 мл/мин); стадии ХБП 3а, 3б, 4, 5 имели 14,4%, 4,7%, 1,3% и 0,6% пациентов, соответственно.
Пациенты, у которых развивалось ОПП, в основном имели терминальные стадии ХБП (4 и 5 стадии).
В течение первых 3 мес. после перенесенной COVID-19 умерли 1,8% пациентов с ХБП. Распределение умерших пациентов по СКФ: 0,4% имели СКФ >90 мл/мин; 1% — 60-89,99 мл/мин; 3,1% — 4559,99 мл/мин; 9,7% — 30-44,99 мл/мин; 15% — 1529,99 мл/мин; 11,1% — <15 мл/мин. Наибольшая смертность наблюдалась у пациентов с ХБП 4 и 5 стадии — 15% и 11,1% пациентов, соответственно. Следует отметить, что, согласно регистру АКТИВ, не наблюдалось достоверного увеличения сердечно-сосудистой смертности у пациентов с ХБП (рис. 8, 9).
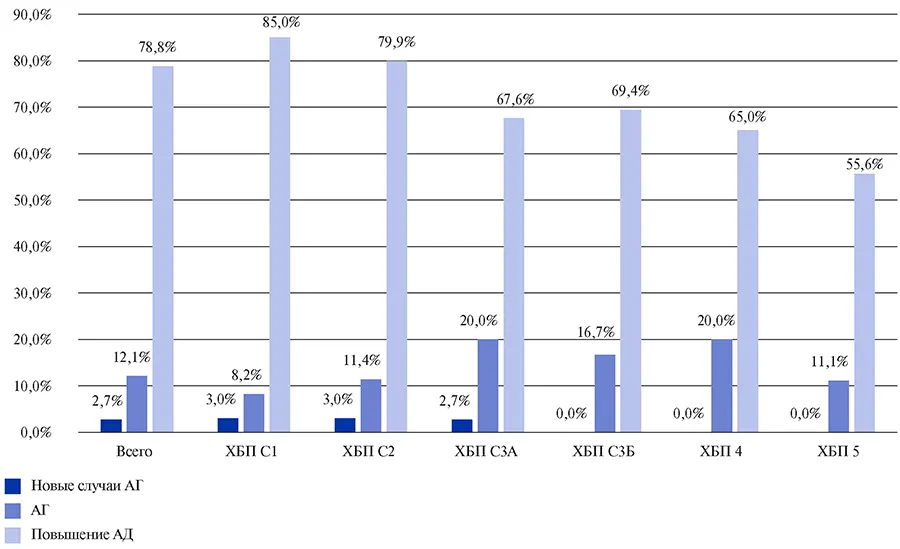
Рис. 8. Повышение артериального давления, АГ, новые случаи АГ в зависимости от исходного уровня СКФ — 3 мес. наблюдения.
Сокращения: АД — артериальное давление, АГ — артериальная гипертензия, ХБП — хроническая болезнь почек.
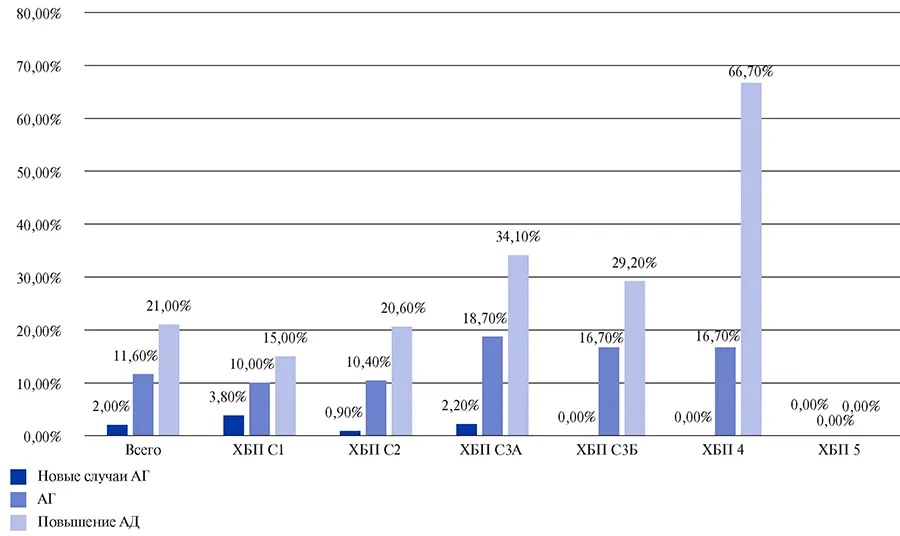
Рис. 9. Повышение артериального давления, АГ, новые случаи АГ в зависимости от исходного уровня СКФ — 6 мес. наблюдения.
Сокращения: АД — артериальное давление, АГ — артериальная гипертензия, ХБП — хроническая болезнь почек.
Спустя 6 мес. после перенесенной COVID-19 смертность у пациентов с ХБП не различалась по стадиям. Это связано с тем, что больные, имеющие продвинутые стадии ХБП, в основном скончались в первые 3 мес. после перенесенной COVID-19.
По данным различных авторов, риск развития ОПП при COVID-19 колеблется примерно от 0,5 до 7% [23-26]. Если анализировать стационарных больных, то такая встречаемость возрастает от 2,9 до 10%. Среди больных, находящихся в отделениях интенсивной терапии, риск развития ОПП повышается до 18-29% и обычно отмечается на 7-9-е сутки.
При анализе пациентов с ОПП из регистра АКТИВ было показано, что его развитие достоверно чаще встречается у больных с присоединением бактериальной инфекции, ИМТ >35 кг/м2, сатурацией <95% и возрастом старше 65 лет. Следует отметить, что пациенты с ОПП имели более выраженный коморбидный фон, имея в среднем 2-3 сопутствующих заболевания.
Заключение совета экспертов:
- В первую очередь применять синдромальный подход у лиц с затрудненной дифференциальной диагностикой между ОПП и ХБП. После восстановления почечной функции следует приступать к определению первопричины возникшего состояния. Такая тактика необходима ввиду зачастую затрудненного сбора анамнеза у пациентов, госпитализированных в стационар с поражением почек;
- Считать основным ориентиром, определяющим функцию почек — расчетную СКФ по формуле CKD-EPI. Иные маркеры повреждения почек, такие как KIM-1, липокалин-6, интерлейкин-18 и другие, нецелесообразны к применению в связи с невысокой доступностью;
- Алгоритм ведения пациентов с ХБП и ОПП в постковидном периоде не должен отличаться от стандартных протоколов, разработанных для лечения данных состояний, вызванных другими причинами, ассоциированными с другими болезнями [27, 28];
- С целью нефропротективной терапии использовать иАПФ и сартаны. По показаниям следует рассмотреть вопрос о применении ингибиторов SGLT-2.
Вопросы назначения ИПП в постковидном периоде
Среди антисекреторных препаратов наиболее часто назначаемыми являются ИПП. Целый ряд пациентов до COVID-19 принимали ИПП для лечения гастрита, язвенной болезни, синдрома диспепсии, гастроэзофагеальной рефлюксной болезни, профилактики гастропатии, вызванной приемом нестероидных противовоспалительных препаратов (НПВП), курсами или базисно. Всем пациентам, госпитализированным с COVID-19, и некоторым амбулаторным больным назначают антикоагулянты и НПВП, что повышает риск эрозивно-язвенных поражений желудочно-кишечного тракта (ЖКТ) и кровотечений из уже имеющихся эрозий. Для гастропротекции практически всем пациентам в период госпитализации назначали ИПП. У полиморбидных больных, получающих политерапию, рациональным выбором являются ИПП с меньшим риском межлекарственных взаимодействий — пантопразол и рабепразол. ИПП относятся к препаратам с широким терапевтическим диапазоном доз и редко приводят к серьезным нежелательным эффектам. Тем не менее при неконтролируемом назначении ИПП вследствие длительной гипохлоргидрии ухудшается всасывание кальция, магния, железа и витамина В12, что может приводить к анемии, остеопорозу, судорожному синдрому. Существует риск поражения почек — развития ОПП и острого тубулоинтерстициального нефрита, развития микроскопического колита, клостридиальной и других желудочно-кишечных инфекций. Поражение ЖКТ может быть связано с изменением микробиоты на фоне даже коротких курсов ИПП, что может приводить развитию клостридиальной инфекции и синдрому избыточного бактериального роста [29-31].
Негативные последствия от приема ИПП имеют дозозависимый эффект. Так, при назначении ИПП 1 раз/сут. риск инфицирования увеличивался в 2 раза, в то время как при двукратном применении — риск был выше в 4 раза [32].
Пациенты с лихорадкой на фоне COVID-19 бесконтрольно принимают НПВП, что приводит к развитию НПВП-ассоциированной гастроэнтеропатии — эрозивно-язвенному поражению и кровотечениям. Длительный прием НПВП был ассоциирован с повышенным риском фатального течения COVID-19 в 1,5 раза, а риск тяжелого течения был выше почти в 3 раза [33].
Препаратом выбора для профилактики НПВП-ассоциированной гастроэнтеропатии может быть ребамипид, что обусловлено его универсальным цитопротективным действием на все этажи ЖКТ и влиянием на синдром повышенной эпителиальной проницаемости. Суточная доза препарата составляет 300 мг (по 100 мг 3 раза/сут.). Максимальная длительность терапии ребамипидом не должна превышать 8 нед. Препарат может быть рекомендован как в виде монотерапии, так и в комбинации с ИПП. В последние месяцы были опубликованы результаты ряда открытых сравнительных исследований эффективности ребамипида при COVID-19 [34] (табл. 5).
Таблица 5
Примеры назначения ИПП и режим их дозирования у пациентов с COVID-19
Препарат | Разовая доза | Суточная доза | Кратность приема |
Омепразол | 20-40 мг | 20-80 мг | 1-2 раза/сут. |
Рабепразол | 10-20 мг | 10-20 мг | 1 раз/сут. |
Пантопразол | 20-40 мг | 40-80 мг | 1-2 раза/сут. |
Эзомепразол | 20-40 мг | 20-40 мг | 1 раз/сут. |
Лансопразол | 15-30 мг | 15-60 мг | 1-2 раза/сут. |
Декслансопразол | 30-60 мг | 30-60 мг | 1 раз/сут. |
Заключение совета экспертов:
- Для снижения частоты кровотечений из ЖКТ необходим мониторинг ФР повреждения ЖКТ, включая лекарственно-индуцированное повреждение НПВП, контроль прогрессирования хронических заболеваний ЖКТ, своевременную коррекцию дозы лекарственных препаратов при снижении функции почек, печени, учет межлекарственных взаимодействий;
- Рекомендовать прием ИПП только пациентам с кислотозависимыми заболеваниями и пациентам высокого риска эрозивно-язвенного поражения верхних отделов ЖКТ [35];
- При политерапии и у полиморбидных пациентов целесообразно назначение пантопразола или рабепразола как ИПП с минимальным риском межлекарственных взаимодействий;
- Длительный прием ИПП вызывает класс-зависимые нежелательные побочные эффекты, обусловленные гипохлоргидрией. Подбирается минимально эффективная доза ИПП, позволяющая контролировать симптомы кислотозависимых заболеваний;
- Рекомендовать прием ребамипида пациентам высокого риска гастроэнтеропатии, а также при наличии противопоказаний для ИПП. Применение: как в виде монотерапии, так и в комбинации с ИПП. Длительность терапии ребамипидом не должна превышать 8 нед. [34].
Антибиотик-ассоциированные поражения пищеварительной системы в период пандемии COVID-19
Антибиотик-ассоциированные поражения пищеварительной системы в период пандемии COVID-19 связаны с повсеместным широким назначением азитромицина (повышение риска в 2,5 раза), респираторных фторхинолонов (риск выше в 6 раз), цефалоспоринов 3 поколения (риск выше в 5 раз), антибиотиков пенициллинового ряда (повышение риска в 3,5 раза), зачастую при отсутствии показаний для проведения данной терапии [29, 30]. В структуре инфекционных причин антибиотик-ассоциированной диареи (ААД) преобладает бактерия Clostridium difficile, что требует особого внимания, учитывая риск развития тяжёлых осложнений, вплоть до летального исхода. Кроме того, токсигенные штаммы способствуют развитию Clostridium difficile-ассоциированной болезни с рецидивирующим течением. Коморбидные состояния, такие как заболевания сердечно-сосудистой системы, СД, а также применение ИПП и пожилой возраст, являются ФР развития ААД, включая Clostridium difficile-ассоциированную болезнь у пациентов, как в острый период COVID-19, так и в постковидный период [36]. При появлении диарейно-го синдрома на фоне терапии или в течение 8 нед. после прекращения приема антимикробных препаратов необходимо обследовать пациента на патогены в стуле, включая токсигенные штаммы Clostridium difficile и Klebsiella oxytoca, которые лидируют в структуре нозокомиальной постковидной ААД (табл. 6, 7).
Таблица 6
Схема терапии колита клостридиальной этиологии у пациентов с COVID-19
Клиническая ситуация | Клиника | Терапия | Дозировки |
Первый эпизод | Лейкоциты <15*109; | Ванкомицин внутрь | 125 мг 4 раза/сут. 10 дней |
Нетяжелое течение | Креатинин <1,5 мг/дл (130 мкмоль/л) | Фидаксомицин внутрь (не зарегистрирован в РФ) | 200 мг 2 раза/сут. 10 дней |
Метронидазол внутрь | 500 мг 3 раза/сут. 10 дней | ||
Первый эпизод | Лейкоциты >5*109; | Ванкомицин внутрь | 125-250 мг 4 раза/сут. 10 дней |
Тяжелое течение | Креатинин >1,5 мг/дл (130 мкмоль/л) | Фидаксомицин внутрь | 200 мг 2 раза/сут. 10 дней |
Первый эпизод | Гипотензия | Ванкомицин внутрь | 500 мг 4 раза/сут. |
Фульминантное течение | или шок | + ванкомицин ректально | 500 мг 1 раз/сут. |
или илеус или мегаколон | + метронидазол внутривенно | 500 мг 4 раза/сут. |
Таблица 7
Схема терапии рецидива колита клостридиальной этиологии у пациентов после перенесенного COVID-19
Клиническая ситуация | Терапия | Дозировки |
Первый рецидив | Ванкомицин внутрь (если был метронидазол) | 125 мг 4 раза/сут. 10 дней |
Фидаксомицин внутрь (если был ванкомицин) | 200 мг 2 раза/сут. 10 дней | |
Ванкомицин внутрь | 125 мг 4 раза/сут.10-14 дней, затем 125 мг 2 раза/сут. 7 дней, затем 1 раз/сут. 7 дней, затем каждые 2 или 3 дня 2-8 нед. | |
Второй и последующие рецидивы | Фидаксомицин внутрь (если был ванкомицин) | 200 мг 2 раза/сут. 10 дней |
Ванкомицин внутрь (если был метронидазол) | 125 мг 4 раза/сут. 10-14 дней, затем 125 мг 2 раза/сут. 7 дней, затем 1 раз/сут. 7 дней, затем каждые 2 или 3 дня 2-8 нед.; 125 мг 4 раза/сут. 10 дней | |
Ванкомицин внутрь, затем рифаксимин внутрь | 400 мг 3 раза/сут. 20 дней |
ААД — это ятрогенное заболевание, риск развития которого может быть снижен оптимизацией антибактериальной терапии. Следует четко и строго определять показания к антибактериальной терапии, рационально подходить к выбору антибиотика при развитии бактериальных осложнений COVID-19, применять пробиотики вместе с антибиотиками и после завершения курса терапии. У пациентов с ААД на фоне COVID-19 рекомендованы как моноштаммовые, так и мультиштаммовые пробиотики.
Заключение совета экспертов:
- Следует четко и строго определять показания к антибактериальной терапии, рационально подходить к выбору антибиотика при развитии бактериальных осложнений COVID-19.
- У пациентов с COVID-19 применение пробиотиков на фоне антимикробной терапии и после завершения курса антибиотиков снижает риск развития ААД, включая Clostridium difficile-ассоциированную болезнь.
- Рекомендовать использование ванкомицина в качестве препарата первой линии терапии антибиотик-ассоциированного колита клостридиальной этиологии [30].
- Рекомендовать использовать метронидазол препаратом второй линии терапии антибиотик-ассоци-ированного колита клостридиальной этиологии [30].
Заключение совета экспертов, основные положения
- При отсутствии или низком (пороговом) уровне антител в ранние сроки после выздоровления (<6 мес.) обосновано проведение вакцинации;
- При сохранении у пациентов одышки на протяжении 2-3 мес. после перенесенной COVID-19 рекомендовано проводить дообследование у врача-терапевта, пульмонолога, кардиолога для уточнения причины;
- Не рекомендовано назначение антифибротических препаратов, применяющихся для лечения прогрессирующих легочных фиброзов (нинтеданиб, пирфинедон и др.), ввиду недостаточного количества данных по их эффективности у пациентов с перенесенной COVID-19 в научной литературе;
- Считать перенесенный COVID-19 самостоятельным ФР формирования тромбозов;
- Рассматривать Д-димер как маркер воспаления и его возможную ассоциацию с неблагоприятным прогнозом смерти от COVID-19 только на госпитальном этапе;
- Не считать уровень Д-димера на госпитальном этапе единственным или ключевым показателем для назначения антикоагулянтной терапии на госпитальном этапе и ее продолжения после выписки, т.к. он не является специфичным маркером тромботических рисков и может учитываться только при отрицательном результате в качестве исключения тромбоза;
- Считать сохраняющийся повышенный уровень тропонина на постгоспитальном этапе прогностическим маркером тяжелого течения ИБС и ХСН;
- Пациенты с ИБС и перенесенным COVID-19 имеют повышенный риск нарушения липидного обмена и требуют дополнительного контроля уровня липопротеидов низкой плотности строго <1,4 ммоль/л, триглицеридов <1,7 ммоль/л. В качестве гиполипидемической терапии предпочтение следует отдавать ингибиторам ГМГ-КоА-редуктазы (статины), при гипертриглициридеми и второй линией препаратов следует назначать фибраты;
- При возникновении ХСН de novo, а также ее декомпенсации у пациентов с анамнезом ХСН, рекомендовать приоритетное использование комплексной квадротерапии (БРА/ингибиторы неприлизина, β-АБ, антагонисты минералокортикоидных рецепторов, ингибиторы SGLT-2) согласно консенсусу экспертов;
- Ожирение обладает большей прогностической ценностью неблагоприятного течения COVID-19 в сравнении с наличием СД 2;
- Рекомендовано переходить на пероральную сахароснижающую терапию параллельно со снижением дозы вводимого инсулина короткого действия вплоть до его полной отмены. Предпочтение следует отдавать ингибиторам SGLT-2;
- Считать основным ориентиром, определяющим функцию почек — расчетную СКФ по формуле CKD-EPI. Иные маркеры повреждения почек, такие как KIM-1, липокалин-6, интерлейкин-18 и другие, нецелесообразны к применению в связи с невысокой доступностью;
- Алгоритм ведения пациентов с ХБП и ОПП в постковидном периоде не должен отличаться от стандартных протоколов, разработанных для лечения данных состояний, вызванных другими причинами, ассоциированными с другими болезнями;
- С целью нефропротективной терапии использовать иАПФ и сартаны. По показаниям следует рассмотреть вопрос о применении ингибиторов SGLT-2;
- Для снижения частоты кровотечений из ЖКТ необходим мониторинг ФР повреждения ЖКТ, включая лекарственно-индуцированное повреждение НПВП, контроль прогрессирования хронических заболеваний ЖКТ, своевременную коррекцию дозы лекарственных препаратов при снижении функции почек, печени, учет межлекарственных взаимодействий;
- При политерапии и у полиморбидных пациентов целесообразно назначение пантопразола или рабепразола как ИПП с минимальным риском межлекарственных взаимодействий.
Литература/References
- World Health Organization (WHO). https://www.who.int.
- COVID-19 rapid guideline: managing the long-term effects of COVID-19 (NG188): Evidence review 5: interventions. London: National Institute for Health and Care Excellence (UK). NICE Guideline 2020;(188). Available from: https://www.ncbi.nlm.nih.gov/books/ NBK567264/.
- Arutyunov GP, Tarlovskaya EI, Arutyunov AG, et al. The International Registry “Analysis of Chronic Non-infectious Diseases Dynamics After COVID-19 (ACTIV SARS-CoV-2) Infection in Adult Patients”: methodology and design. Kardiologiia. 2020;60(11):35-7. (In Russ.) Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Международный регистр “Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2 (АКТИВ SARS-CoV-2)”: методология и дизайн. Кардиология. 2020;60(11):35-7. doi:10.18087/cardio.11.n1398.
- Goёrtz YMJ, VanHerck M, Delbressine JM, et al. Persistent symptoms 3 months after a SARS-CoV-2 infection: the post-COVID-19 syndrome?. ERJ OpenRes. 2020;6(4):00542-2020. doi:10.1183/23120541.00542-2020.
- Temporary guidelines “Medical rehabilitation after a new coronavirus infection (COVID-19). Version 2 (31.07.2020)” (approved by the Ministry of Health of Russia). (In Russ.) Временные методические рекомендации “Медицинская реабилитация при новой коронавирусной инфекции (COVID-19). Версия 2 (31.07.2020)” (утв. Минздравом России). https://xn--80aesfpebagmfblc0a.xn--p1ai/ai/doc/461/attach/28052020_Preg_ COVID-19_v1.pdf.
- Li Y, Zhao K, Wei H, et al. Dynamic relationship between D-dimer and COVID-19 severity. Br J Haematol. 2020;190(1):e24-e27. doi:10.1111/bjh.16811.
- Thachil J, Tang N, Gando S, et al. ISTH interim guidance on recognition and management of coagulopathy in COVID-19. Journal of Thrombosis and Haemostasis. 2020;18(5):1023-6. doi:10.1111/jth.14810.
- Shlyakhto YV, Arutyunov GP, Belenkov YuN, et al. Use of Statins, Anticoagulants, Antiplatelet and Antiarrhythmic Drugs in Patients With COVID-19. The Agreed Experts’ Position of Russian Society of Cardiology, Eurasian Association of Therapists, National Society on Atherothrombosis, Societies of Experts in Urgent Cardiology, Eurasian Arrhythmology Association. Kardiologiia. 2020;60(6):4-14. (In Russ.) Шляхто Е. В., Арутюнов Г. П., Беленков Ю. Н. и др. Применение статинов, антикоагулянтов, анти-агрегантов и антиаритмических препаратов у пациентов с COVID-19. Кардиология. 2020;60(6):4-14. doi:10.18087/cardio.2020.6.n1180.
- Zhang Y, Coats AJS, Zheng Z, et al. Management of heart failure patients with COVID-19: a joint position paper of the Chinese Heart Failure Association & National Heart Failure Committee and the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2020;22(6):941-56. doi:10.1002/ejhf.1915.
- Seferovic PM, Ponikowski P, Anker SD, et al. Clinical practice update on heart failure 2019: pharmacotherapy, procedures, devices and patient management. An expert consensus meeting report of the Heart Failure Association of the European Society of Cardiology. Eur J Heart Fail. 2019;21(10):1169-86. doi:10.1002/ejhf.1531.
- Arutyunov GP, Tarlovskaya EI, Arutyunov AG, et al. The International Registry “Analysis of the dynamics of Comorbid diseases in patients who have been infected with SARSCoV-2 (AKTIV SARS-CoV-2)”: analysis of 1,000 patients. Russian Journal of Cardiology. 2020;25(11):4165. (In Russ.) Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Международный регистр “Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2” (АКТИВ SARS-CoV-2): анализ 1000 пациентов. Российский кардиологический журнал. 2020;25(11):4165. doi:10.15829/1560-4071-2020-4165.
- Kang Y, Chen T, Mui D, et al. Cardiovascular manifestations and treatment considerations in COVID-19. Heart. 2020;106(15):1132-41. doi:10.1136/heartjnl-2020-31.
- Shlyakhto EV. State and prospects for the development of cardiology care in the Russian Federation. Meeting of the Profile Commission on Cardiology, Ministry of Health of the Russian Federation, Moscow [Powerpoint presentation]. 2018. (In Russ.) Шляхто Е. В. Состояние и перспективы развития кардиологической помощи в Российской Федерации. Заседание Профильной комиссии по кардиологии МЗ РФ, Москва [презентация Powerpoint]. 2008. https://cardioweb.ru/glavnyj-vneshtatnyj-spetsialist-kardiolog-minzdrava-rossii/item/1998-profilnaya-komissiya.
- Arutyunov GP, Tarlovskaya EI, Arutyunov AG, et al. International register “Dynamics analysis of comorbidities in SARS-CoV-2 survivors” (AKTIV SARS-CoV-2): analysis of predictors of shortterm adverse outcomes in COVID-19. Russian Journal of Cardiology. 2021;26(4):4470. (In Russ.) Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Международный регистр “Анализ динамики Коморбидных заболеваний у пациенТов, перенесших инфицирование SARS-CoV-2” (АКТИВ SARS-CoV-2): анализ предикторов неблагоприятных исходов острой стадии новой коронавирусной инфекции. Российский кардиологический журнал. 2021;26(4):4470. doi:10.15829/1560-4071-2021-4470.
- Characteristics of COVID-19 patients dying in Italy: report based on available data on March 20th, 2020 COVID-19 Surveillance Group — Rome, Italy: Instituto Superiore Di Sanita, 2020. https://www.epicentro.iss.it/coronavirus/bollettino/Report-COVID-2019_20_ marzo_eng.pdf
- Arutiunov GP, Tarlovskaia EI, Koziolova NA, et al. The Agreed Experts’ Position of the Eurasian Association of Therapists, on strategies for clinical management of patients with comorbidities infected with SARS-Cov-2. Therapeutic Archive. 2020;92(9):108-124. Арутюнов Г. П., Тарловская Е. И., Козиолова Н. А. и др. Согласованная позиция экспертов Евразийской ассоциации терапевтов по вопросам тактики ведения пациентов c коморбидной патологией, инфицированных SARS-Cov-2. Терапевтический архив. 2020;92(9):108-124. doi:10.26442/00403660.2020.09.000703.
- 2020 Clinical practice guidelines for Chronic heart failure. Russian Journal of Cardiology. 2020;25(11):4083. (In Russ.) Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
- Chazova IE, ZhernakovaYuV on behalf of the experts. Clinical guidelines. Diagnosis and treatment of arterial hypertension. Systemic Hypertension. 2019;16(1):6-31. (In Russ.) Чазова И. Е., Жернакова Ю. В. от имени экспертов. Клинические рекомендации. Диагностика и лечение артериальной гипертонии. Системные гипертензии. 2019;16(1):6-31. doi:10.26442/2075082X.2019.1.190179.
- 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2019;40(5):475. doi:10.1093/eurheartj/ehy686.
- Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-104. doi:10.1093/eurheartj/ehy339.
- Writing Committee; Maddox TM, Januzzi Jr JL, et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2021;77(6):772-810. doi:10.1016/j.jacc.2020.11.022.
- Shlyakhto EV, Konradi AO, Arutyunov GP, et al. Guidelines for the diagnosis and treatment of circulatory diseases in the context of the COVID-19 pandemic. Russian Journal of Cardiology. 2020;25(3):3801. (In Russ.) Шляхто Е. В., Конради А. О., Арутюнов Г. П. и др. Руководство по диагностике и лечению болезней системы кровообращения в контексте пандемии COVID-19. Российский кардиологический журнал. 2020;25(3):3801. doi:10.15829/1560-4071-2020-3-3801.
- Huang C, Wang Y, Li X, et al. Clinical Features of Patients Infected With 2019 Novel Coronavirus in Wuhan, China. Lancet. 2020;395(10223):497-506. doi:10.1016/S0140-6736(20)30183-5.
- Wang D, Hu B, Hu C, et al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA. 2020;201585. doi:10.1001/jama.2020.1585.
- Yang X, Yu Y, Xu J, et al. Clinical Course and Outcomes of Critically Ill Patients With SARS-CoV-2 Pneumonia in Wuhan, China: A Single-Centered, Retrospective, Observational Study. Lancet Respir Med. 2020;8(5):475-81. doi:10.1016/S2213-2600(20)30079-5. Erratum in: Lancet Respir Med. 2020;8(4):e26.
- Deng Y, Liu W, Liu K, et al. Clinical Characteristics of Fatal and Recovered Cases of Coronavirus Disease 2019 (COVID-19) in Wuhan, China: A Retrospective Study. Chin Med J (Engl). 2020;133(11):1261-7. doi:10.1097/CM9.0000000000000824.
- Association of Nephrologists. Clinical recommendations. Chronic kidney disease (CKD). 2021. (In Russ.) Ассоциация нефрологов. Клинические рекомендации Хроническая болезнь почек (ХБП). 2021. https://www.rusnephrology.org/wpcontent/ uploads/2020/12/CKD_final.pdf.
- Association of Nephrologists. Scientific Society of Nephrologists of Russia. Association of Anesthesiologists-Resuscitators of Russia. National Society of Specialists in the Field of Hemapheresis and Extracorporeal Hemocorrection. Clinical recommendations. Acute kidney injury (AKI). 2020. (In Russ.) Ассоциация нефрологов. Научное общество нефрологов России. Ассоциация анестезиологов-реаниматологов России. Национальное общество специалистов в области гемафереза и экстракорпоральной гемокорреции. Клинические рекомендации “Острое повреждение почек (ОПП)”. 2020. https://www.rusnephrology.org/wp-content/uploads/2020/12/AKI_final.pdf.
- Langford BJ. Bacterial co-infection and secondary infection in patients with COVID-19: a living rapid review and meta-analysis. Clin Mic Inf. 2020;26(12):1622-9. doi:10.1016/j. cmi.2020.07.016.
- McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children: 2017 update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66:e1-48. doi:10.1093/cid/cix1085.
- Savarino V, Marabotto E, Furnari M, et al. Latest insights into the hot question of proton pump inhibitor safety — a narrative review. Dig Liver Dis. 2020;52(8):842-52. doi:10.1016/j. dld.2020.04.020.
- Lee SW, Ha EK, Yeniova AO, et al. Severe clinical outcomes of COVID-19 associated with proton pump inhibitors: a nationwide cohort study with propensity score matching. Gut. 2021;70(1):76-84. doi:10.1136/gutjnl-2020-322248.
- Almario CV, Chey WD, Spiegel BMR. Increased Risk of COVID-19 Among Users of Proton Pump Inhibitors. Am J Gastroenterol. 2020;115(10):1707-15. doi:10.14309/ ajg.0000000000000798.
- Drapkina OM, Mayev IV, Bakulin IG, et al. Provisional guidelines: “Diseases of the digestive organs in conditions of a pandemic new coronavirus infection (COVID-19)”. Version 2. Profilakticheskaya Meditsina. 2021;25(5-2):4-41. (In Russ.) Драпкина О. М., Маев И. В., Бакулин И. Г. и др. Временные методические рекомендации: “Болезни органов пищеварения в условиях пандемии новой коронавирусной инфекции (COVID-19)”. Версия 2. Профилактическая медицина. 2021;25(5-2):4-41. doi:10.17116/ profmed2021240524.
- Robb CT, Goepp M, Rossi AG, Yao, C. Non-steroidal anti-inflammatory drugs, prostaglandins, and COVID-19. Br J Pharmacol. 2020;177:4899-920. doi:10.1111/ bph.15206.
- Paramo-Zunzunegui J, Ortega-Fernandez I, Calvo-Espino P, et al. Severe Clostridium difficile colitis as potential late complication associated with COVID-19. Ann R Coll Surg Engl. 2020;102(7):e176-e179. doi:10.1308/rcsann.2020.0166.
